
智慧标签自动识别及供应链整体解决方案服务商
19年专注 1000余家知名企业应用价值见证021-51699869

智慧标签自动识别及供应链整体解决方案服务商
19年专注 1000余家知名企业应用价值见证021-51699869
什么是CE认证?
医疗器械产品的CE认证包括医疗器械指令和体外诊断医疗器械指令,代号分别是93/42/EEC和98/79/EC。当然还有一个有源植入性医疗器械指令,只是由于涉及到的产品风险极高而覆盖范围有限,此处不单独介绍。医疗器械指令对于不同类别的医疗拟器械有不同的要求和不同的认证模式,体外诊断医疗器械(IVD)分为LISTA和LISTB以及Other类别。
指令的更新安排
2017年5月医疗器械法规(EU)2017/745已经发布,将取代现有的医疗器械指令(MDD)93/42/EEC,自2017年5月25日起,医疗器械企业有三年的过渡期。MDR与MDD(93/42/EEC)存在显著差异。除了内容多了三倍以外,主要差异包括:有源植入性器械和范围扩大至包含具有美学或非医疗目的但在功能和风险特征方面类似于医疗器械的产品。对于使用纳米材料口服产品的器械有新的分类规则和符合性审核要求。
同时,欧盟也发布了体外诊断医疗器械法规(EU)2017/746法规以替代体外诊断医疗器械指令(IVDD)98/79/EC,自2017年5月25日起,体外诊断医疗器械企业有五年过渡期。
MDD的分类规则
MDD的分类并不是像美国的FDA或者中国CFDA具体给出每种产品的分类结果,而是给出了一个分类指南文件,另外有一份持续更新的争议器械指南文件来对有争议的器械加以说明的模式来运作的。
图是对于非侵入器械的4个规则,这个里面的器械肯定是无源器械,肯定是不进入患者人体的,依据具体的用途看适用哪个规则。
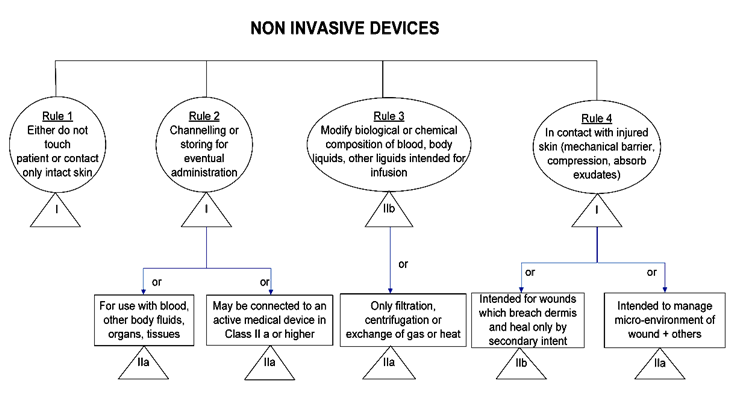
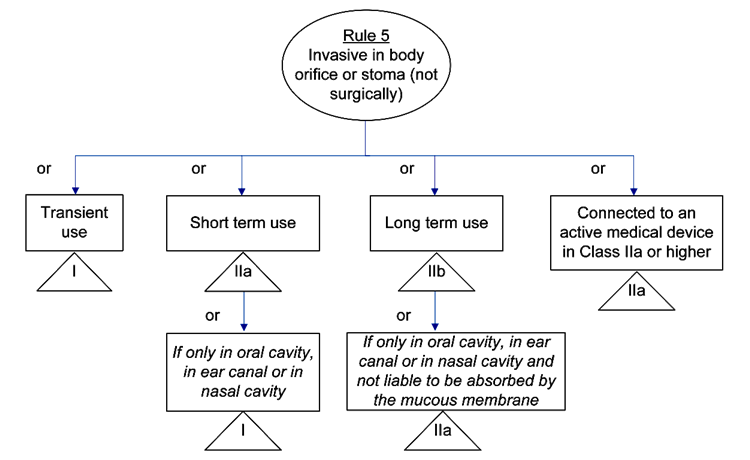
规则5-8是侵入性器械的分类依据
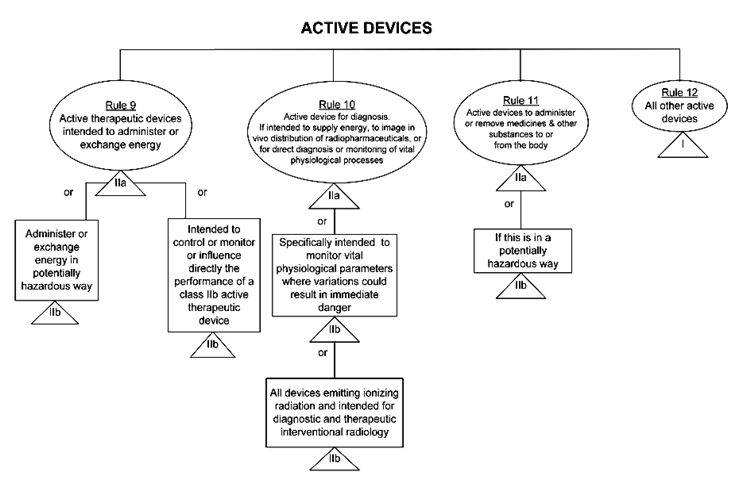
规则9-12是有源器械类别

规则13-18属于特殊规则
IVDD的分类规则
IVDD的分类规则比较简单,主要是需要判定产品是否属于Annex II中的LISTA和LISTB中,如果在属于高风险需要公告机构参与,如果不是则属于低风险。
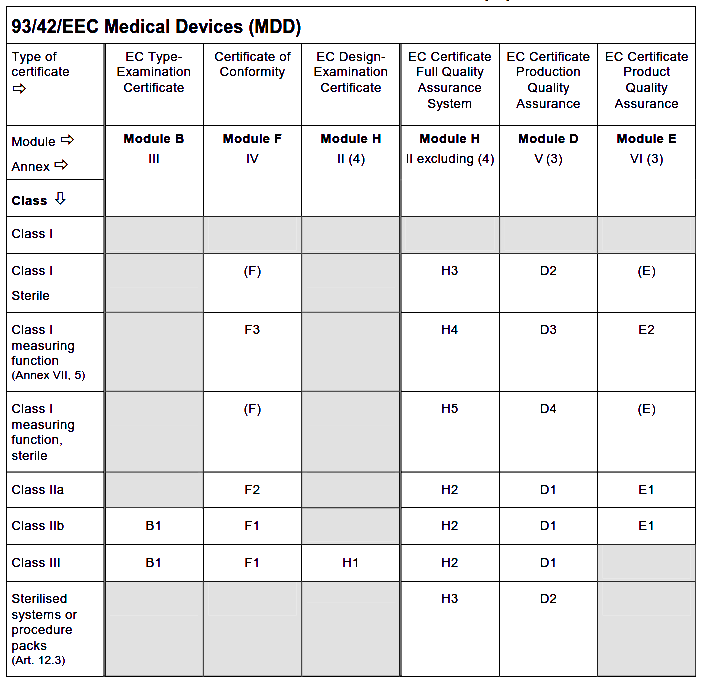
MDD认证模式
IVDD认证模式
