
智慧标签自动识别及供应链整体解决方案服务商
19年专注 1000余家知名企业应用价值见证
详询热线
021-51699869

智慧标签自动识别及供应链整体解决方案服务商
19年专注 1000余家知名企业应用价值见证021-51699869
UDI码包含两部分:
Device Identifier (DI) 器械唯一识别码
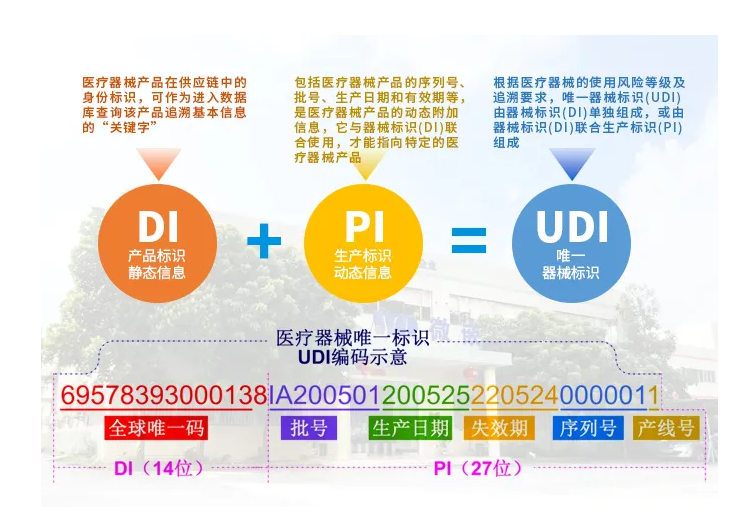
由FDA认可的颁发机构如国际发证机构GS1颁发。这些编号包括了:
(1) the labeler贴标商
(2) the specific version or model of a device.产品的特定版本或型号信息;
Production Identifier(s) (PI):生产唯一识别码
主要应包含的信息有产品批号,序列号,失效日期,生产日期等。由制造商生成和管理。
FDA要求:
所有医疗器械贴标商Labeler应在规定日期内在产品包装/标签上包含符合UDI要求的条形码,该条码应包含以下内容:
a. UDI条码颁证机构如GS1颁发的厂商识别代码等组成DI;
b. 贴标商按照条码机构的条码格式生成的包含产品批号等信息的PI;
在FDA规定的强制执行日期开始,贴标商自行或委托IRC代为其向FDA UDI数据库GUDID报送出口美国的医疗器械产品的UDI条码相关信息。